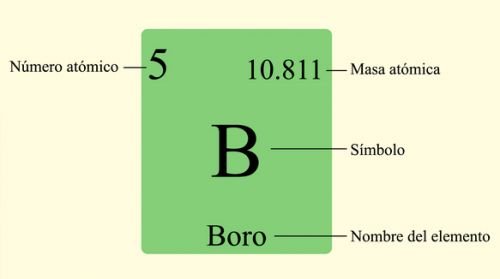
Lunes, 27 de Abril del 2020
El propósito de hoy es explicar que el átomo está formado por el núcleo y la nube electrónica, donde se encuentran los niveles de energía.
SESIÓN 4
EL INTERIOR DEL ÁTOMO
Observa la siguiente imagen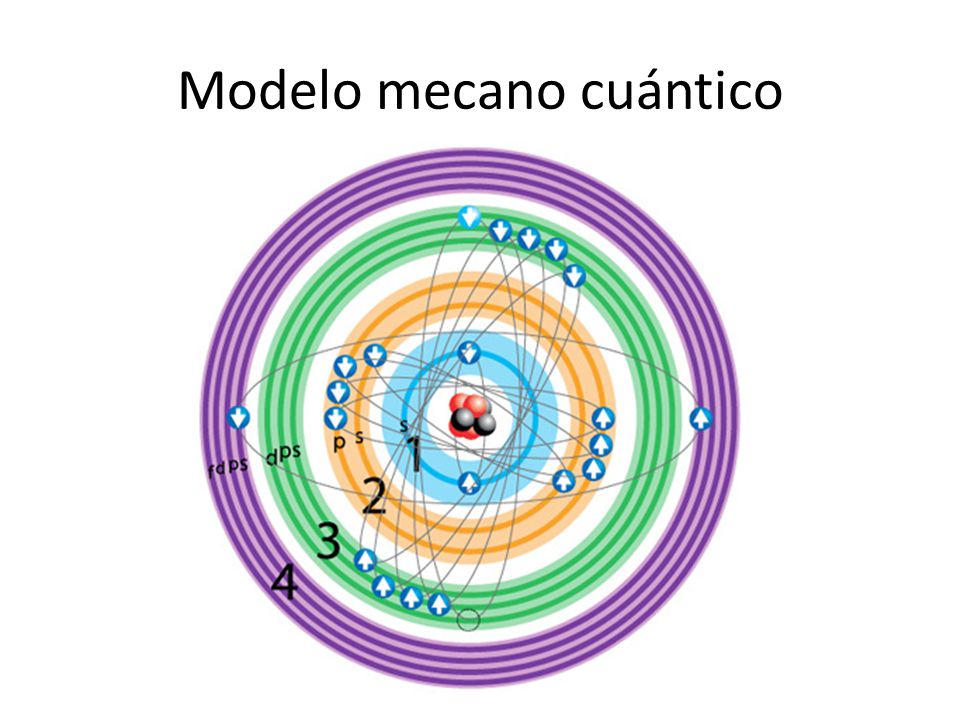
Después de observar la imagen se les plantea las siguientes preguntas:(en la classroom)
- ¿Dónde está ubicado el electrón en el átomo?
- ¿Qué evidencia permitió a los científicos determinar la ubicación más probable del electrón?
- ¿Por qué el electrón no esta en un lugar exacto del átomo en un momento determinado?
- El átomo de Oro tiene 79 electrones ¿Cómo están organizados los electrones alrededor del núcleo?
- Si se tiene un átomo de aluminio y otro de oxígeno, ¿Son de igual tamaño?, ¿Tienen igual cantidad de electrones?
A continuación se te invita a que realices la observación del vídeo "Los rayos catódicos" https://www.youtube.com/watch?v=1dPv5WKBz9k
Después de observar el vídeo responde a las siguientes preguntas:(en la classroom)
- ¿De qué forma se propagan los rayos catódicos?
- ¿Por qué el imán desplaza al haz luminoso?
- ¿Qué dice el principio de incertidumbre?
- ¿Cuándo un electrón emite y absorbe energía?
- ¿Por qué es imposible determinar donde se encuentra un electrón?
- ¿Cuáles son los fenómenos eléctricos?
- ¿Por qué los cuerpos se atraen o repelen?
- De acuerdo con la lectura, haz un esquema o dibujo en el que se indique dónde es probable encontrar el electrón?
- Los niveles de energía (n) son las regiones de la nube electrónica donde se encuentran los electrones con similar valor de energía. Los niveles de energía se designan por las letras mayúsculas K, L, M, N, O, P, Q,

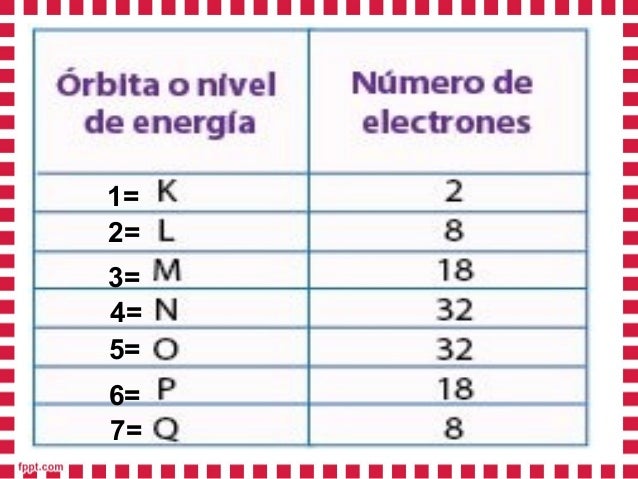
- Los subniveles de energía (l) cada nivel de energía de un átomo tiene uno o más subniveles, debido a que cada uno tiene una capacidad fija para alojar electrones (e-). Los subniveles se designan por las letras s, p, d, f.

- Los orbitales (ml) son regiones de la nube electrónica donde la posibilidad de encontrar un electrón es máxima. Un orbital puede albergar como máximo 2 electrones que se diferencian entre sí por el sentido de giro sobre su eje.


Distribución de electrones
La configuración electrónica de un átomo es el modo como están distribuidos los electrones alrededor del núcleo. Se rige por tres principio:
- Príncipio de mínima energía. Los electrones se colocan en el orbital de menor energía disponible.
- Principio de exclusión de Pauli. En un átomo no puede haber dos electrones que tengan los cuatro números cuánticos iguales.
- Principio de la máxima multiplicidad de Hund. uando por los dos principio anteriores se pueden dar varias configuraciones, la más favorable es la que permite el mayor número de electrones con el mismo spin (desapareados)
Configuración de electrones

Números cuánticos
Los números cuánticos se utilizan para describir orbitales atómicos y para identificar los electrones que se ubican en ellos.
- Número cuántico principal n. El valor del número cuántico principal n toma valores enteros (1, 2, 3 ...) y define el tamaño del orbital.
- Número cuántico secundario o azimutal l. El valor del momento angular, indica la forma del orbital y el momento angular l = (desde 0 hasta n-1)
Para l =
0, orbitales s
Para l =
1, orbitales p
Para l =
2, obitales
d
Para l
= 3, orbitales f
- Número cuántico ml. El valor del número cuántico magnético, define la orientación espacial del orbital frente a un cambpo magnético externo.
ml = -l, -l+1,
…, 0, …, l+1, l
- Número cuántico ms. El valor del spin, puede ser +1/2 ó -1/2. Indican los posibles giros del electrón alrededor de su propio eje.
Ahora responde a la siguiente pregunta:
- ¿Explica el por qué la ubicación de los niveles de energía? (en la classroom)
Finalmente resuelve la ficha de aplicación 3 sobre configuración electrónica.(en la classroom)